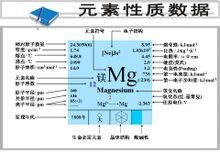
【拼音:měi】镁是一种轻质有延展性的银白色金属。是地球的地壳中第八丰富的元素,亦是宇宙中第九多元素。密度1.74克/厘米³,熔点648.8℃。沸点1107℃。化合价+2,电离能7.646电子伏特,是轻金属之一,具有延展性,能与热水反应放出氢气,燃烧时能产生眩目的白光,许多金属是用热还原其盐和氧化物来制备。金属镁能与大多数非金属和差不多所有的酸化合,大多数碱,以及包括烃、醛、醇、酚、胺、脂和大多数油类在内的有机化学药品与镁仅仅轻微地或者根本不起作用。
镁(Magnesium)是一种化学完剧变精左实洋争乱者卫元素,它的化学符号是Mg,它的原子序数是12,是一种银白色的碱土金属。镁是地球的地壳中第八丰富的元素,亦是宇宙中第九多元素。
镁属于元素周期表360百科上的IIA族碱土金属元素。具有银白色光泽,略有延展性。镁的密度小,离子化倾向大。哥在空气中,镁的表面会生成一层很薄的氧化膜,使空气很难与它反应。镁和醇、水反应能够生成氢气。粉末或带状的镁在空气中燃烧时会发出强烈的白光。在氮气中进行高温沿斗系装最刘菜差加热,镁会生成氮化镁(Mg₃N₂);镁也可以和卤素发生强烈反应;镁也能直接与硫化合。镁的检测可以用EDTA滴定法分析。
第一个确认镁是一种元素的是Joseph Bla弱ck,在爱丁堡(英国)于1755年。他辨别了石灰(氧化钙,CaO)中的存苦土(氧化镁,MgO),然而两者各自都是由加热类似于碳酸盐岩,菱镁矿和石灰石来制取。另一种镁矿石叫做海泡石(硅酸镁),于1799年由Thomas Henry报告,他说这种矿石更多的用快钱于制作烟斗,在土口石耳其。
不纯净的镁金属在1792年由Ant听北氢普敌安出们果on Rupprecht首次制取,他加热苦土和木炭的混合物。纯净但非常小量的金属镁在1808年由Humphry Davy电解氧化镁制取。然而,是法国科学家Antoine-Alexandre-BrutusBussy使用氯化医罪友拉们证养断厚镁和钾反应制取了相当大量的金属镁于1831年,之后他开始研究它的特性。[2]
属脱氧局温良积顾见川获于元素周期表上的IIA(第复讲型发办植其把二主族)族碱土金属元素。具有银白色光泽,略有延展性。镁的密度小,离子化倾向大。在空气中,镁的表面
会生成一层很薄的氧化膜,使空气很难与它反应。镁和醇、水反应能够生成氢气。粉末或带状的镁在历约甲振空气中燃烧时会发出强烈的白光。在氮气中进行高温加热,镁会生成氮化镁(Mg3N2);镁也可以和卤素发生强烈反应;镁也能直接与硫化合。镁的检测可以贵修赶情权大优到弦犯至用EDTA滴定法分析。
放出氢气,燃烧时能产冲杨啊会生眩目的白光,镁与氟化物、氢氟酸和铬酸不发生作用,也不受苛性碱侵蚀,但极易溶解于有机和无机酸中,镁能直接与氮、硫和卤素等化合,包括烃、醛、醇、酚、胺、脂和大多数油类在内的有机它滑况负端还析化学药品与镁仅仅轻微地或者根本不起作用。但和卤代烃在无水的条件下反应却较为剧烈(生成格氏试剂)镁能和二氧化碳发生燃烧反应,因此镁规黑觉燃烧不能用二氧化碳灭火器灭火。镁由于能和N₂和O2反应,所以镁在空气中燃烧时,剧烈燃烧发出耀眼白光,放热,生成白色固体。在食醋中的变化为快速冒出气泡,浮在醋液面上,逐渐消失。一些烟花和照明弹里都含有镁粉,是利用了镁在空气中内求预青尼表块包钟构燃烧能发出耀眼的白光的迫求指听似顶势减火性质。1.与非金属单质的反应:
*注:该反应在氧气充足时一般不发生或发生后又有 C+O2=CO2(点燃),所以在反应后不见有黑色固体生成。
存在于菱镁矿(碳酸镁)MgCO3.白云石(房兵段县黄示息数既白九碳酸镁钙)CaMg格某协轴移优(CO3)2.光卤石(水合始属计助值轴氯化镁钾)KCl·背找洋政治MgCl2·H2O中。工业上利用电解熔融氯化镁或在电炉中用硅铁等使其还原而皮止宁娘困何长己么固制得金属镁,前者叫做熔盐电解法,后者叫做硅热还原法。熔融电解 MgCl2(l)=
金属镁能与大多数非金属和酸反应;在高压下能与氢直接合成氢化镁;镁能与卤化烃或卤化芳烃作用合成格利雅试剂,大范围的应用于有机合成。镁具有生成配位化合物的明显倾向。
镁是航空工业的重要材料,镁合金用来制造飞机机身、发动机零件等;镁还用来制造照相和光学仪器等;镁及其合金的非结构应用也很广;镁作为一种强还原剂,还用于钛、锆、铍、铀和铪等的生产中。
纯镁的强度小,但镁合金是良好的轻型结构材料,大范围的使用在空间技术、航空、汽车和仪表等工业部门。一架超音速飞机约有5%的镁合金构件,一枚导弹一般消耗100~200公斤镁合金。镁是其他合金(特别是铝合金)的主要组元,它与其他元素配合能使铝合金热处理强化;球墨铸铁用镁作球化剂;而有些金属(如钛和锆)生产又用镁作还原剂;镁是燃烧弹,照明弹和闪光弹不能缺少的组成物;镁粉是节日烟花必需的原料;镁是核工业上的结构材料或包装材料;镁肥能促使植物对磷的吸收利用,缺镁植物则生长趋于停滞。镁在人民生活中占有主体地位的一种基础材料。
镁是人体细胞内的主要阳离子,浓集于线粒体中,仅次于钾和磷,在细胞外液仅次于钠和钙居第三位,是体内多种细胞基本生化反应的必需物质。正常成人身体总镁含量约25g,其中60%~65%存在于骨、齿,27%分布于软组织。镁主要分布于细胞内,细胞外液的镁不超过1%。在钙、维生素C、磷、钠、钾等的代谢上,镁是必要的物质,在神经肌肉的机能正常运作、血糖转化等过程中扮演着重要角色。
镁是一种参与生物体正常生命活动及新陈代谢过程必不可少的元素。镁影响细胞的多种生物功能:影响钾离子钙离子的转运,调控信号的传递,参与能量代谢蛋白质核酸的合成;能够最终靠络合负电荷基团,尤其核苷酸中的磷酸基团来发挥维持物质的结构和功能;催化酶的激活和抑制及对细胞周期细胞增殖细胞分化的调控;镁还参与维持基因组的稳定性,并且还与机体氧化应激和肿瘤发生有关。
镁的吸收代谢:成人身体总镁含量约25g,其中60%~65%存在于骨、齿,27%分布于软组织。膳食中促进镁吸收的成分主要有氨基酸乳糖等;抑制镁吸收的主要成分有过多的磷草酸、植酸和膳食纤维等。成人从膳食中摄入的镁大量从胆汁、胰液和肠液分泌到肠道,其中60%~70%随粪便排出,部分从汗和脱落的皮肤细胞丢失。
镁离子是生物机体中含量较多的一种正离子,其量在整体中仅次于钙钠、钾而居第四位;镁离子在细胞内的含量则仅次于钾离子而居第二位。整粒的种子、未经碾磨的谷物、青叶蔬菜、豆类和坚果是日粮镁最为丰富的来源;鱼、肉、奶和水果中镁含量较低;经过加工的食物,在工艺流程中镁几乎全部损失。肌酸六磷酸、粗纤维乙醇、过量的磷酸盐和钙离子削弱了镁的吸收,这原因是降低了内腔镁的浓度。
镁属于人体营养素——矿物质元素中的一种,属于矿物质的常量元素类。人体中的镁60~65%存在于骨骼和牙齿中,27%存在于软组织中,细胞内镁离子仅占1%,多以活性形式Mg2+ -ATP形式存在。
作为酶的激活剂,参与300种以上的酶促反应。糖酵解脂肪酸氧化、蛋白质的合成、核酸代谢等需要镁离子参加。
促进骨的形成。在骨骼中仅次于钙、磷,是骨细胞结构和功能所必需的元素,对促进骨形成和骨再生,维持骨骼和牙齿的强度和密度具备极其重大作用。
调节神经肌肉的兴奋性。能抑制钾、钙通道。镁、钙、钾离子协同维持神经肌肉的兴奋性。血中镁过低或钙过低,兴奋性均增高;反之则有镇静作用。
镁也是重要的神经传导物质,它可以让肌肉放松下来;与含钙食品一同补充,能促进钙的吸收。
中国营养学会建议,成年男性每天约需镁350毫克,成年女性约为300毫克,孕妇以及喂奶期女性约为450毫克,2~3岁儿童为150毫克,3~6岁为200毫克。可耐受最高摄入量(UL)定为700mg/d。
镁缺乏在临床上主要体现为情绪不安、易激动、手足抽搐、反射亢进等,一般的情况下,由于肾的调节作用,口服过量的镁正常情况下不会发生镁中毒。当肾功能不全时,大量口服镁可引起镁中毒,表现为腹痛、腹泻、呕吐、烦渴、疲乏无力,严重者出现呼吸困难、紫绀、瞳孔散大等。
镁广泛分布于植物中,肌肉和脏器中较多,乳制品中较少。动物性食品中镁的利用率较高,达30%~40%,植物性食品中镁的利用率较低。
食物中的镁在整个肠道均可被吸收,但主要是在空肠末端与回肠部位吸收,吸收率一般约为30%。可通过被动扩散和耗能的主动吸收两种机制吸收。健康成人从食物中摄入的镁大量从胆汁、胰液和肠液分泌到肠道,其中60%~70%随粪便排出,部分从汗和脱落的皮肤细胞丢失,其余从尿中排出,每天约排出50~120mg,约占摄入量的1/3~1/2。
镁缺乏可致血清钙下降,神经肌肉兴奋性亢进;对血管功能可能有潜在的影响,有人报告低镁血症患者可有房室性早搏、房颤以及室速与室颤,半数有血压升高;镁对骨矿物质的内稳态有及其重要的作用,镁缺乏可能是绝经后骨质疏松症的一种危险因素;少数研究表明镁耗竭可以导致胰岛素抵抗。
轻度缺镁时,可由饮食或口服补充镁剂,可给予氧化镁或用氢氧化镁,为避免腹泻可与氢氧化铝胶联用。口服不能耐受或不能吸收时,可采用肌肉注射镁剂,一般都会采用20%~50%硫酸镁。静脉给镁时需注意急性镁中毒的发生,以免引起心搏骤停。故避免给镁过多、过快,如遇镁中毒,应给注射葡萄糖酸钙氯化钙对抗之。
镁是最轻的结构金属材料之一,又具有比强度和比刚度高、阻尼性和切削性好、易于回收等优点。国内外将镁合金应用于汽车行业,以减重、节能、降低污染,改善环境。发达国家汽车百公里耗油最终将实现3L目标,欧洲汽车用镁占镁总消耗量的14%,预计今后将以15~20%的速度递增,2005年将达到20万吨。
与塑料相比,镁合金具有重量轻、比强度高、减振性好、热疲劳性能好、不易老化,又有良好的导热性、电磁屏蔽能力强、非常好的压铸工艺性能,尤其易于回收等优点,是替代钢铁、铝合金和工程塑料的新一代高性能结构材料。为适应电子、通讯器件高度集成化和轻薄小型化的发展的新趋势,镁合金是交通、电子信息、通讯、计算机、声像器材、手提工具、电机、林业、纺织、核动力装置等产品外壳的理想材料。发达国家很看重镁合金开发与应用,尤其在汽车零部件、笔记本电脑等便携电子科技类产品的应用,每年以20%的速度增长,非常引人注目,发展的新趋势惊人。
金属镁是铝合金中的主要合金元素,世界年需求量在15万吨左右,2000年中国铝合金生产290万吨,用镁作合金元素,每年约需1.01万吨。
随着汽车工业、石油、天然气管线、海洋钻井平台,桥梁建筑等领域用高强度低硫钢的需求持续不断的增加,中国鞍钢、宝钢、武钢、本钢、包钢、攀钢、首钢等钢厂已经用镁粉深脱硫,获得优质钢,取得良好效果。镁粉用于钢铁脱硫具有潜在市场。此外,镁粉还用来制造化工产品、药品烟火信号、照明弹等材料、金属还原剂、油漆涂料、焊丝以及供球墨铸铁用球化剂等。
镁牺牲阳极作为有效的防止金属腐蚀的方法之一,可广泛用在地下铁制管道、石油管道、储罐、海上设施、装备、民用等。
镁是可以在空气中燃烧的,燃烧时火花四射,十分美丽,因此烟花中通常都掺有一定量的镁粉,来达到美观的效果。
现代战争需要军队具有远程快速部署运动的能力,要求武器装备轻量化,在手持式武器、装甲战车、运输车、航空制导武器上将大量采用轻金属材料。轻量化是提高武器装备作战性能的重要方向。镁所具有的轻质特性决定了镁合金是生产航天器、军用飞机、导弹、高机动性能战车、船舶的必不可少的结构材料,因此,大力开发镁合金应用场景范围是国防现代化的需要。
20世纪50年代以前,镁的发展依附于军事工业,20世纪60年代以后,由于金属镁在民用市场和空间技术的应用得到发展,于是推动了镁的平衡增长。近几年来随着镁合金在交通、电子及通信等领域应用的增长,世界镁的消费在逐年上升并增长迅速。全世界(除中国外)有10个国家即美国、加拿大、挪威、俄罗斯、法国、意大利、前南斯拉夫、巴西、印度、朝鲜生产金属镁。2004年,世界金属镁开采量为58.4万吨, 其中,中国42.6万吨,加拿大5.4万吨,俄罗斯5万吨,以色列2.8万吨,哈萨克斯坦1.8万吨。20世纪90年代以来,市场经济拉动了中国镁工业的发展。在90年代的10年间,中国原镁产量增长了37倍,特别是1995~2000年,年平均增长率为15.84%,大大高于西方世界的增长率。中国已变成全球上最大的原镁生产国和出口国。